La tabla periódica es uno de los logros más significativos en la historia de la ciencia. Su desarrollo ha sido un proceso largo y complejo, lleno de descubrimientos y avances que han transformado nuestra comprensión de la materia. Este artículo explora tanto la fascinante historia de la tabla periódica como su funcionamiento y utilidad en la química moderna.
Los Primeros Intentos de Clasificación
Antes del siglo XIX, los científicos ya intentaban clasificar los elementos conocidos. En 1789, Antoine Lavoisier, considerado el padre de la química moderna, publicó una lista de 33 elementos que dividió en gases, metales, no metales y tierras. Sin embargo, esta clasificación era muy básica y no reflejaba las propiedades químicas de los elementos.
La Ley de las Tríadas
En 1817, Johann Wolfgang Döbereiner observó que ciertos grupos de tres elementos (tríadas) tenían propiedades químicas similares y que el peso atómico del elemento central era aproximadamente la media de los otros dos. Este fue uno de los primeros intentos de encontrar un patrón en las propiedades de los elementos.
La Ley de las Octavas
En 1864, John Newlands propuso la Ley de las Octavas, sugiriendo que cuando los elementos se ordenaban por peso atómico, cada octavo elemento tenía propiedades similares. Aunque su idea fue inicialmente ridiculizada, sentó las bases para la organización periódica de los elementos.
La Tabla de Mendeleev
El verdadero avance llegó en 1869, cuando el químico ruso Dmitri Mendeléyev presentó su tabla periódica. Mendeléyev organizó los elementos conocidos en filas y columnas según sus propiedades químicas y pesos atómicos. Lo más notable fue que dejó espacios vacíos para elementos que aún no se habían descubierto, prediciendo sus propiedades con sorprendente precisión. Su tabla no solo organizaba los elementos de manera lógica, sino que también permitía hacer predicciones sobre nuevos elementos.
Descubrimientos y Ajustes
A medida que se descubrían nuevos elementos, la tabla de Mendeléyev se ajustaba y expandía. En 1913, Henry Moseley reorganizó la tabla según el número atómico en lugar del peso atómico, lo que resolvió varias inconsistencias. Este cambio fundamental llevó a la forma moderna de la tabla periódica.
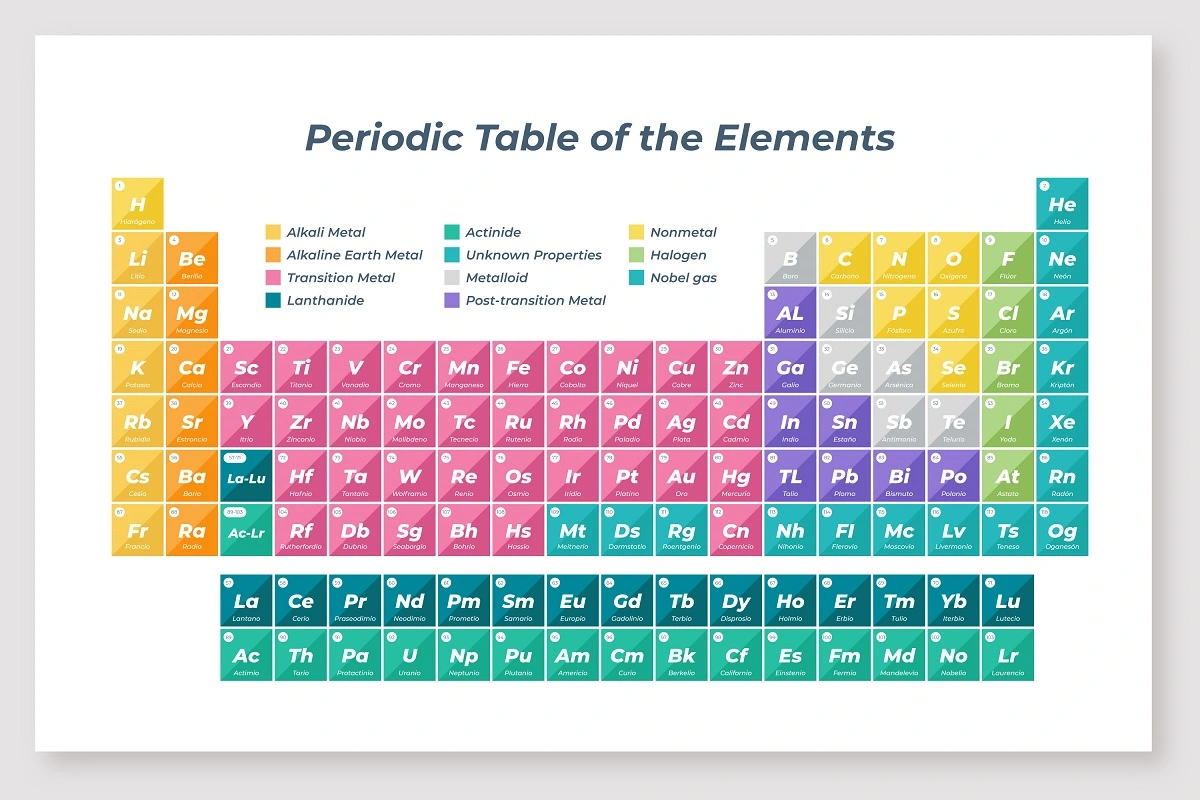
Organización de la Tabla Periódica
La tabla periódica moderna está organizada en filas y columnas. Cada elemento está representado por un símbolo químico y se coloca en un lugar específico según su número atómico, que es el número de protones en su núcleo.
• Periodos: Las filas horizontales se llaman periodos. Hay siete periodos en la tabla periódica, y cada uno representa un nivel de energía principal de los electrones en los átomos.
• Grupos: Las columnas verticales se llaman grupos o familias. Hay 18 grupos en total. Los elementos dentro de un mismo grupo tienen propiedades químicas similares debido a que tienen el mismo número de electrones en su capa de valencia.
Tipos de Elementos
La tabla periódica divide los elementos en varias categorías principales:
• Metales: Se encuentran en la parte izquierda y central de la tabla. Son buenos conductores de electricidad y calor, y suelen ser maleables y dúctiles.
• No metales: Se encuentran en la parte superior derecha de la tabla. Son malos conductores de electricidad y calor, y suelen ser frágiles en estado sólido.
• Metaloides: Tienen propiedades intermedias entre metales y no metales. Se encuentran a lo largo de la línea que separa metales y no metales en la tabla.
Propiedades Periódicas
La tabla periódica permite observar tendencias en las propiedades de los elementos:
• Electronegatividad: La capacidad de un átomo para atraer electrones hacia sí mismo. Aumenta de izquierda a derecha a lo largo de un periodo y disminuye de arriba a abajo en un grupo.
• Radio Atómico: La distancia desde el núcleo del átomo hasta el límite de la nube de electrones. Disminuye de izquierda a derecha a lo largo de un periodo y aumenta de arriba a abajo en un grupo.
• Energía de Ionización: La energía necesaria para remover un electrón de un átomo en estado gaseoso. Aumenta de izquierda a derecha a lo largo de un periodo y disminuye de arriba a abajo en un grupo.
Uso de la Tabla Periódica
La tabla periódica es esencial para:
Predicción de Reacciones Químicas: Al conocer la posición de un elemento en la tabla, los químicos pueden predecir cómo reaccionará con otros elementos.
Desarrollo de Nuevos Materiales: La tabla ayuda a identificar elementos con propiedades específicas necesarias para crear nuevos materiales.
Educación y Investigación: Es una herramienta educativa clave para enseñar química y una referencia constante en la investigación científica.
Elementos Sintéticos y Expansión de la Tabla
En el siglo XX, los avances en la física nuclear permitieron la creación de elementos sintéticos. Estos elementos, que no se encuentran en la naturaleza, se añaden a la tabla periódica a medida que se descubren. El elemento más pesado conocido hasta ahora es el oganesón (Og), con el número atómico 118.
La Importancia de la Tabla Periódica
La tabla periódica es una herramienta esencial en la química y otras ciencias. Permite a los científicos predecir las propiedades de los elementos y sus compuestos, entender las reacciones químicas y desarrollar nuevos materiales. Además, es una representación visual de la estructura atómica y las tendencias periódicas, como la electronegatividad, el radio atómico y la energía de ionización.
La historia de la tabla periódica es un testimonio del ingenio humano y la búsqueda del conocimiento. Desde los primeros intentos de clasificación hasta la tabla moderna, cada paso ha sido un avance hacia una comprensión más profunda de la materia. La tabla periódica no solo organiza los elementos de manera lógica, sino que también es una herramienta poderosa que facilita el estudio y la aplicación de la química. Su estructura permite a los científicos entender mejor las propiedades de los elementos y sus interacciones, lo que es crucial para el avance de la ciencia y la tecnología.